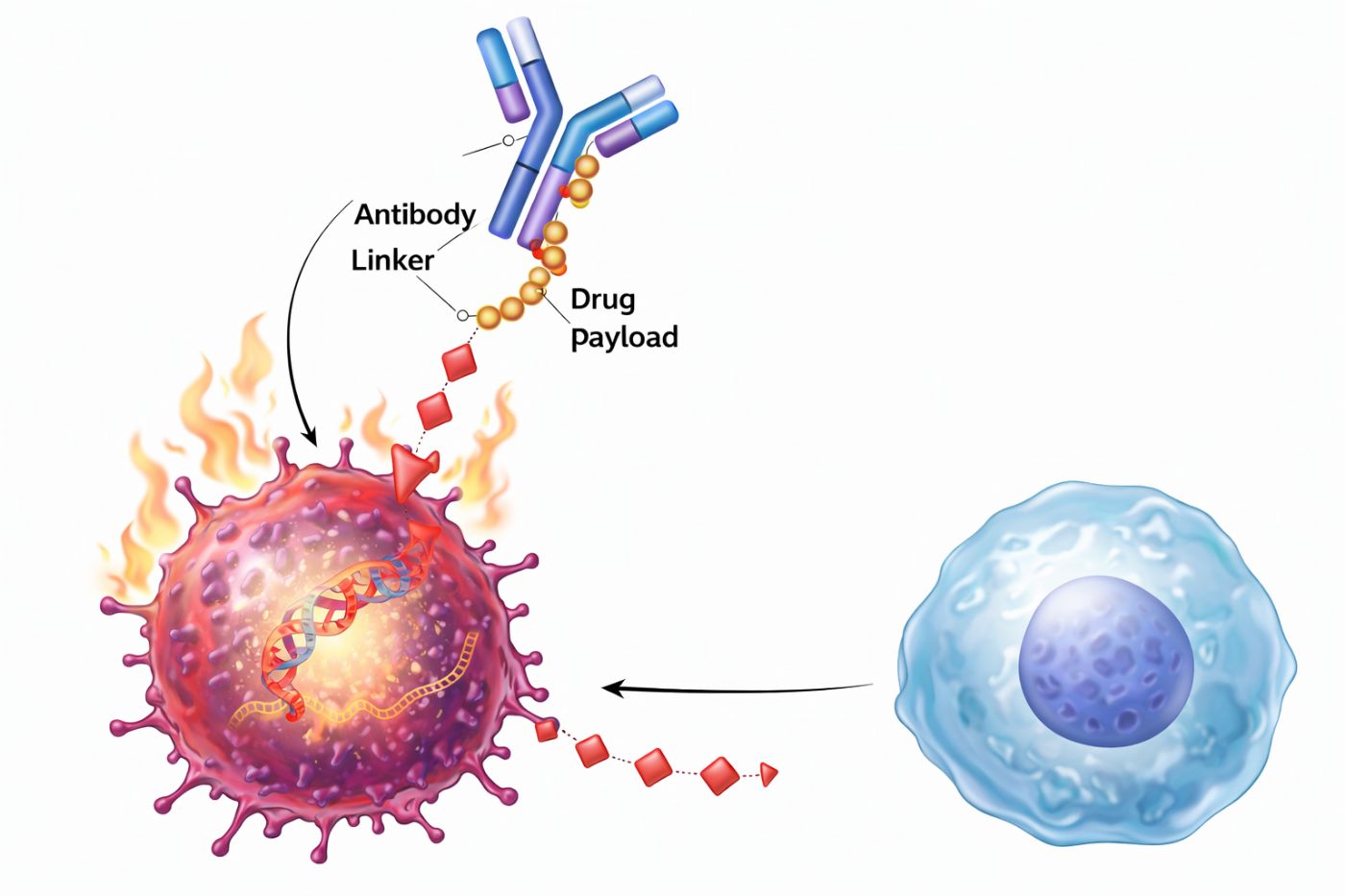
Hedefli Antikor-İlaç Konjugatları (ADC'ler), kanser tedavisinde bir "akıllı füze" gibi çalışan yenilikçi bir ilaç sınıfıdır. Bu moleküller, kanser hücrelerini öldüren güçlü bir kemoterapi ilacını (yük veya toksin), kanser hücrelerinin yüzeyindeki belirli bir hedefe (antijene) bağlanan bir monoklonal antikor (hedefleme kısmı) aracılığıyla doğrudan kanserli dokuya taşır. Amaç, sağlıklı dokuya verilen zararı en aza indirirken, kemoterapiyi doğrudan tümör hücresine ulaştırmaktır.
ADC'ler, üç ana bileşenden oluşur:
Etki Mekanizması:
ADC'ler, hedefledikleri antijene ve taşıdıkları toksine göre farklılık gösterir. En bilinen bazı hedefler ve bunlara yönelik ilaçlar şunlardır:
HER2 Hedefli ADC'ler:İnsan Epidermal Büyüme Faktörü Reseptörü 2 (HER2) adı verilen bir proteinin kanser hücre yüzeyindeki aşırı ekspresyonu. Meme, mide ve bazı akciğer kanserlerinde görülür.
Mekanizma: HER2'ye bağlanarak ilacı doğrudan HER2 pozitif kanser hücrelerine taşırlar.
Örnekleri:
Trastuzumab Emtansine (T-DM1, Kadcyla): Trastuzumab antikoruna bağlı bir mikrotübül inhibitörü olan emtansine (DM1) taşır. Özellikle daha önce Trastuzumab ve taksan kemoterapisi almış HER2 pozitif metastatik meme kanserinde kullanılır.
Trastuzumab Deruxtecan (T-DXd, Enhertu): Trastuzumab antikoruna bağlı bir topoizomeraz I inhibitörü olan deruxtecan taşır. Daha güçlü bir toksin içerir ve sadece HER2 pozitif değil, düşük HER2 ekspresyonuna sahip meme kanserlerinde de etkili olduğu gösterilmiştir. Ayrıca mide kanseri ve bazı akciğer kanserlerinde de kullanılır.
Kullanım Alanları: HER2 pozitif/düşük ekspresyonlu meme kanseri, HER2 pozitif mide kanseri, HER2 ekspresyonu olan bazı akciğer kanserleri.
EGFR Hedefli ADC'ler: Epidermal Büyüme Faktörü Reseptörü (EGFR) proteininin kanser hücre yüzeyindeki ekspresyonu. Akciğer, kolorektal ve baş-boyun kanserlerinde rol oynar.
Mekanizma: EGFR'ye bağlanarak ilacı taşıyan ADC'lerdir.
İlaç Örnekleri: Özellikle Patritumab Deruxtecan (akciğer kanseri için araştırmada) gibi ilaçlar geliştirilmektedir.
Kullanım Alanları: EGFR ekspresyonu olan solid tümörler (araştırma aşamasında).
Trop-2 Hedefli ADC'ler:Tümör İlişkili Kalsiyum Sinyal Transdüseri 2 (Trop-2) adı verilen, birçok epitelial kanserde aşırı eksprese olan bir hücre yüzeyi proteini.
Mekanizma: Trop-2'ye bağlanarak ilacı kanser hücrelerine taşır.
Gelişmiş İlaç Örnekleri:
Sacituzumab Govitecan: Trop-2'ye bağlanan bir antikor ile topoizomeraz I inhibitörü olan SN-38'i (irinotekanın aktif metaboliti) taşır.
Kullanım Alanları: Üçlü negatif meme kanseri (TNBC), ürotelyal (mesane) kanseri, hormon reseptörü pozitif/HER2 negatif meme kanseri.
Nectin-4 Hedefli ADC'ler:Nectin-4 adı verilen bir hücre adezyon molekülü, ürotelyal kanserlerde yaygın olarak yüksek seviyelerde bulunur.
Mekanizma: Nectin-4'e bağlanarak ilacı hedefler.
Gelişmiş İlaç Örnekleri:
Enfortumab Vedotin: Nectin-4'e bağlanan bir antikor ile mikrotübül inhibitörü olan MMAE'yi (monomethyl auristatin E) taşır.
Kullanım Alanları: İleri evre ürotelyal (mesane) kanseri.
CD30 Hedefli ADC'ler:CD30 adı verilen bir hücre yüzeyi reseptörü, özellikle Hodgkin lenfoma ve bazı Anaplastik Büyük Hücreli Lenfoma (ALCL) türlerinde bulunur.
Mekanizma: CD30'a bağlanarak ilacı taşır.
Gelişmiş İlaç Örnekleri:
Brentuximab Vedotin :CD30'a bağlanan bir antikor ile mikrotübül inhibitörü olan MMAE'yi taşır.
Kullanım Alanları: Hodgkin lenfoma, sistemik Anaplastik Büyük Hücreli Lenfoma.
TFRC Hedefli ADC'ler : Transferrin Reseptör 1 (TFRC) veya CD71 olarak da bilinen bir protein, birçok kanser türünde artmış ekspresyon gösterir. Kanser hücreleri demir alımı için bu reseptöre bağımlıdır.
Mekanizma: TFRC'ye bağlanarak ilacı kanser hücrelerine taşır.
İlaç Örnekleri: Klinik denemelerde farklı kanser türleri için geliştirilmektedir.
Kullanım Alanları: Çeşitli solid tümörler ve hematolojik maligniteler (araştırma aşamasında).
ADC'ler genellikle intravenöz (IV) infüzyon yoluyla uygulanır. Tedaviler belirli döngüler halinde, genellikle 3 haftada bir veya daha sık aralıklarla verilir. Tedavinin süresi ve sıklığı, kanserin türüne, evresine, ADC'nin türüne ve hastanın tedaviye verdiği yanıta bağlı olarak değişir.
Avantajları
Dezavantajları
Hedefli Antikor-İlaç Konjugatları, kanser tedavisinde umut vadeden ve hızla gelişen bir alandır. Daha az yan etkiyle daha hedefe yönelik tedavi sunma potansiyelleri, onları geleceğin onkoloji pratiğinde önemli bir yer edindirmektedir.
Copyright 2025 | Prof. Dr. Abdullah Sakin | Tıbbi Onkoloji (Kanser) Uzmanı