CAR T-hücre tedavisi, hastanın kendi bağışıklık sistemi T hücrelerinin, laboratuvarda genetik olarak modifiye edilerek kanser hücrelerini hedefleyip yok etme yeteneği kazandırıldığı, yenilikçi bir adoptif immünoterapi türüdür. Bu tedavi, özellikle diğer yöntemlere dirençli hematolojik (kan) kanserlerde çığır açan başarılar göstermiştir ve kişiye özel bir tedavi yaklaşımı sunar.
CAR (Chimeric Antigen Receptor - Kimerik Antijen Reseptör), bir antikorun antijen bağlama bölgesini bir T hücresi sinyalizasyon bölgesine birleştiren sentetik bir reseptördür. Bu "kimerik" yapı, T hücrelerinin, normalde bağışıklık sistemi tarafından göz ardı edilebilecek kanser hücrelerini doğrudan ve MHC (Major Histocompatibility Complex) bağımsız bir şekilde tanımasını sağlar.
Temel Etki Mekanizması:
CAR T-hücre tedavileri, hedefledikleri antijene ve CAR'ın yapısına göre farklılık gösterir.
1. CD19 Hedefli CAR T-Hücre Tedavileri
Hedef: CD19, normal B lenfositlerinin ve birçok B hücreli kanser hücresinin (örn. B hücreli lösemiler ve lenfomalar) yüzeyinde bulunan bir proteinidir. CD19, B hücrelerinin gelişiminde ve işlevinde kritik bir rol oynar.
Mekanizma: Bu CAR T hücreleri, CD19 antijenini taşıyan tüm B hücrelerini (hem kanserli hem de normal B hücrelerini) hedef alır ve yok eder. Bu nedenle, tedavi sonrası hastalarda bir süre B hücre aplazisi (B hücrelerinin yokluğu) ve buna bağlı olarak enfeksiyon riski görülebilir.
Onaylı İlaç Örnekleri:
Tisagenlecleucel: Nükseden veya dirençli B hücreli Akut Lenfoblastik Lösemi (ALL) ve bazı Diffüz Büyük B Hücreli Lenfoma (DLBCL) türlerinde kullanılır.
Axicabtagene Ciloleucel: Nükseden veya dirençli DLBCL ve Foliküler Lenfoma (FL) türlerinde kullanılır.
Brexucabtagene Autoleucel: Mantle Hücreli Lenfoma (MCL) ve Erişkin Akut Lenfoblastik Lösemi (ALL) gibi durumlarda kullanılır.
Lisocabtagene Maraleucel: Nükseden veya dirençli DLBCL ve diğer bazı B hücreli lenfomalar için onaylıdır.
Kullanım Alanları: Özellikle nükseden/dirençli B hücreli akut lenfoblastik lösemi (ALL), diffüz büyük B hücreli lenfoma (DLBCL), foliküler lenfoma (FL) ve mantle hücreli lenfoma (MCL) gibi hematolojik kanserler.
2. BCMA Hedefli CAR T-Hücre Tedavileri
Hedef: B-hücresi Olgunlaşma Antijeni (BCMA), özellikle plazma hücrelerinin yüzeyinde yüksek oranda eksprese edilen bir proteindir. Multipl Miyelom, plazma hücrelerinin kanseridir ve BCMA bu kanser için ideal bir hedeftir.
Mekanizma: BCMA'yı hedefleyen CAR T hücreleri, Multipl Miyelom hücrelerine spesifik olarak bağlanır ve onları yok eder.
Onaylı İlaç Örnekleri:
Idecabtagene Vicleucel: Daha önce birden fazla tedavi almış, nükseden veya dirençli Multipl Miyelom hastalarında kullanılır.
Ciltacabtagene Autoleucel: Abecma'ya benzer şekilde, ağır ön tedavi görmüş nükseden veya dirençli Multipl Miyelom hastaları için onaylıdır ve oldukça yüksek yanıt oranları göstermiştir.
Kullanım Alanları: Nükseden veya dirençli Multipl Miyelom.
3. Diğer Hedefler ve Gelişmekte Olan CAR T-Hücre Tedavileri
CAR T-hücre tedavisi alanında araştırmalar hızla devam etmekte olup, farklı kanser türleri ve hedefler için yeni CAR T ürünleri geliştirilmektedir:
Solid Tümörlerdeki Hedefler: GLP-1R (pankreas kanseri), CEA, GPC3 (hepatosellüler karsinom), HER2 (meme kanseri), PSMA (prostat kanseri), Mesothelin (pankreas ve akciğer kanserleri) gibi çeşitli antijenler solid tümörlerde hedef olarak araştırılmaktadır. Solid tümörlerde CAR T etkinliği, tümör mikroçevresi ve T hücrelerinin tümöre penetrasyonu gibi zorluklar nedeniyle henüz hematolojik kanserlerdeki başarı seviyesine ulaşamamıştır.
Diğer Hematolojik Hedefler: CD20, CD22 gibi diğer B hücre antijenleri veya AML'de (Akut Miyeloid Lösemi) hedef olarak görülen CD33, CD123 gibi antijenler için de CAR T hücreleri geliştirilmektedir.
"Off-the-Shelf" (Hazır) CAR T Hücreleri (Allojenik CAR T): Mevcut CAR T tedavileri hastanın kendi hücrelerinden (otolog) yapılırken, allojenik CAR T hücreleri sağlıklı bir donörden alınan hücrelerden üretilir. Bu, tedaviye daha hızlı erişim sağlayabilir ve maliyetleri düşürebilir, ancak GvHD (graft-versus-host hastalığı) riskini artırabilir. Araştırmalar, bu riski azaltmak için gen düzenleme teknikleri kullanılarak donör T hücrelerini modifiye etme üzerine odaklanmaktadır.
Yeni Nesil CAR Tasarımları: CAR'ların daha güçlü sinyalizasyon domainleri (örn. 4-1BB, CD28), tümör mikroçevresindeki baskılayıcı sinyalleri aşan mekanizmalar veya birden fazla antijeni hedefleyen (bispesifik) CAR'lar gibi tasarımlar geliştirilmektedir.
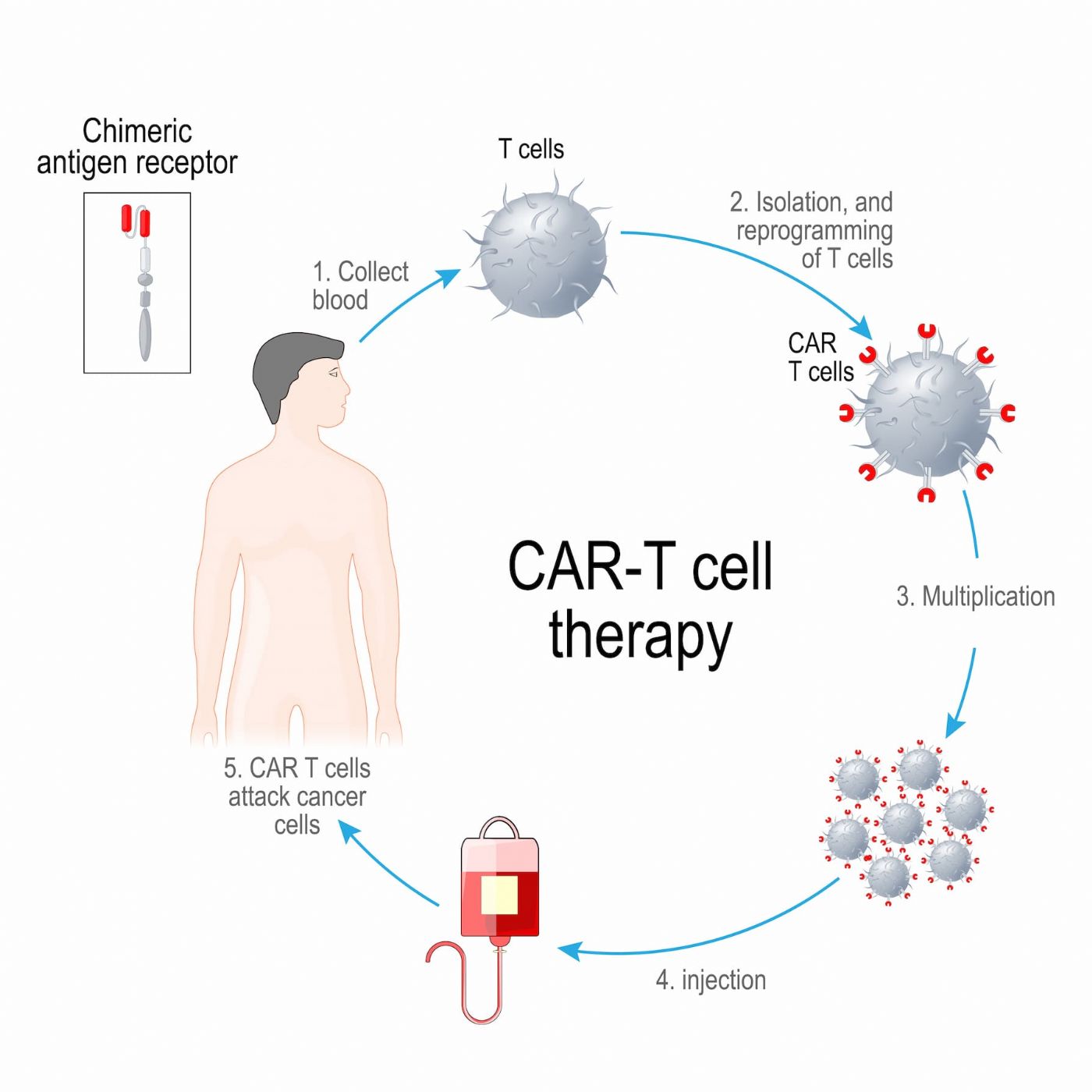
Kullanım Şekilleri
CAR T-hücre tedavisi, karmaşık ve çok aşamalı bir süreçtir:
Avantajları
Dezavantajları
Ciddi ve Hayatı Tehdit Edici Yan Etkiler: En önemli dezavantajı, hayatı tehdit edebilecek ciddi yan etki riskidir:
Sitokin Salım Sendromu (CRS): CAR T hücrelerinin kanser hücrelerini öldürürken salgıladığı sitokinlerin yol açtığı sistemik inflamatuar bir reaksiyondur. Ateş, hipotansiyon, solunum yetmezliği, organ disfonksiyonu gibi belirtilerle seyreder ve yoğun bakım gerektirebilir.
İmmün Efektör Hücre İlişkili Nörotoksisite Sendromu (ICANS): Beyni ve sinir sistemini etkileyen nörolojik yan etkilerdir. Konfüzyon, nöbetler, afazi (konuşma güçlüğü), yürüme güçlüğü gibi belirtiler görülebilir.
B Hücresi Aplazisi: CD19 hedefli tedavilerde, sağlıklı B hücreleri de hedef alındığı için uzun süreli B hücre yokluğu (aplazisi) ve buna bağlı olarak enfeksiyon riski oluşabilir.
Diğer Yan Etkiler: Tümör lizi sendromu, sitopeniler (kan hücre sayılarında düşüş), alerjik reaksiyonlar.
CAR T-hücre tedavisi, onkoloji alanında bir devrim niteliğindedir ve özellikle bazı kan kanserlerinde yaşamı tehdit eden durumlarda hastalara yeni bir şans sunmuştur. Sürekli devam eden araştırmalar, bu tedavileri daha güvenli, daha erişilebilir hale getirmeyi ve solid tümörlerdeki etkinliğini artırmayı hedeflemektedir.
Copyright 2025 | Prof. Dr. Abdullah Sakin | Tıbbi Onkoloji (Kanser) Uzmanı